meta data for this page
Ideales Gas
Allgemeines
Als ein ideales Gas wird ein Gas bezeichnet das dem Gesetz von Gay-Lussac nach den Wert $\beta = 3,661 \cdot 10^-3 \frac{1}{\mathrm{°C}}$ besitzt. Reale Gase besitzen diesen Wert nur für niedrige Drücke und hohe Temperaturen, trotzdem ist das Modell eines idealen Gases für viele Anwendungen ausreichend. Anschaulich besteht ein ideales Gas aus punktförmigen Teilchen die lediglich mit den Wänden ihres Gefäßes stoßen und ansonsten keinerlei Wechselwirkung unterliegen, da sie nur kurzzeitig untereinander elastisch stoßen, keine Kräfte aufeinander ausüben und selbst kein Eigenvolumen besitzen.
Das Modell eines idealen Gases versagt spätestens beim Wechsel des Aggregatzustandes.
Zustandsgleichung: allgemeine Gasgleichung
Ideale Gase werden durch die allgemeine Gasgleichung beschrieben $$ p V = N k_\mathrm{B} T.$$ Mit den Zustandsgrößen eines thermodynamischen Systems dem Druck $p$ , dem Gasvolumen $V$, $N$ Anzahl der Teilchen, $T$ der Temperatur und $k_\mathrm{B}$ die Boltzmann-Konstante. Diese Gleichung lässt sich aus der kinetischen Gastheorie herleiten1).
Häufig wird auch eine andere Form der allgemeinen Gasgleichung verwendet $$ p V = n R T \quad \text{,} \quad p V = m R_\mathrm{s} T \quad \text{oder} \quad p V = \frac{2}{3} N \bar{E}_\mathrm{kin}.$$ Dabei ist $n$ die Stoffmenge, $R$ die universelle Gaskonstante, $m$ die Gesamtmasse, $R_\mathrm{s}$ die spezifische Gaskonstante und $\bar{E}_\mathrm{kin}$ die mittlere kinetische Energie, siehe Temperatur.
Anwendung der allgemeinen Gasgleichung
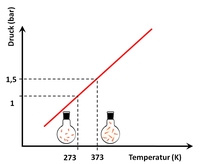
Aus der allgemeinen Gasgleichung folgt, dass ein eingesperrtes ideales Gas ($N=\mathrm{konst.}$) nur Temperatur, Druck und Volumen als variable Größen hat. Hält man die Temperatur eines idealen Gases konstant, z.B. durch externes Heizen oder Kühlen, und variiert gleichzeitig das Volumen durch Kompression oder Expansion, so muss sich folglich der Druck ändern, dies wird als isotherme Kompression bzw. Expansion bezeichnet2). Wird hingegen das Volumen konstant gehalten so ist dies eine isochore Änderung, bei konstanten gehaltenen Druck eine isobare Änderung.
Gase können Prozesse durchlaufen die physikalische Arbeit $W$ verrichten, z.B. durch Verbrennungsprozesse oder dem Stirling-Prozess. Dies geschieht immer durch eine Volumenänderung $\mathrm{d}V$ und ist proportional zum volumen-abhängigen Druck $p(V)$, dies wird beschrieben durch $$W=\int_{V_\mathrm{1}}^{V_\mathrm{2}}p(V)\,\mathrm{d}V\quad \left[\mathrm{J} \right] \, .$$ Daher ist für eine Bestimmung der verrichteten Arbeit ein p-V-Diagramme besonderst nützlich. Für ein ideales Gas folgt somit sofort $$W=\int_{V_\mathrm{1}}^{V_\mathrm{2}}\frac{nRT}{V}\,\mathrm{d}V.$$ Diese Gleichung vereinfacht sich für isotherme Prozesse zu $$W=nRT\int_{V_\mathrm{1}}^{V_\mathrm{2}}\frac{\mathrm{d}V}{V}=nRT\cdot \mathrm{ln}(\frac{V_\mathrm{2}}{V_\mathrm{1}})\,.$$ Für eine Ausdehnung gilt $V_\mathrm{2} > V_\mathrm{1}$ und damit ist die geleistete Arbeit positiv.
Bei isochoren Änderungen ist $V_\mathrm{2} = V_\mathrm{1}$ und $\mathrm{d}V=0$, die geleistete Arbeit ist somit $W=0$.
Für isobare Änderungen ist der Druck $p$ eine Konstante und für die geleistete Arbeit gilt $W=p\int_{V_\mathrm{1}}^{V_\mathrm{2}}\,\mathrm{d}V=p(V_\mathrm{2}-V_\mathrm{1})=p\Delta V$. Dies gilt z.B. für langsame Erwärmungen.