meta data for this page
Reale Gase
Allgemeines
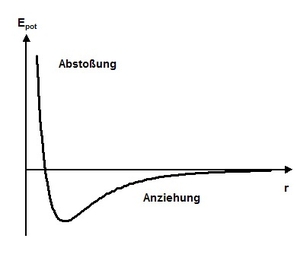
Reale Gase unterscheiden sich von idealen Gasen dadurch, dass die Gasteilchen des realen Gases eine Ausdehnung besitzen und durch Kräfte, wie die Van-der-Waals-Kraft wechselwirken. Wie in der nebenstehenden Grafik zu sehen, sind die Wechselwirkungskräfte (negative Ableitung des Potentiales) im Nahbereich abstoßend und im Fernbereich anziehend. Dieses Potential wird Lennard-Jones-Potential genannt und wird hauptsächlich durch die Van-der-Waals-Kräfte hervorgerufen1).
Van-der-Waals-Gleichung
Die Van-der-Waals-Gleichung, die reale Gase beschreibt, lässt sich aus der idealen Gasgleichung herleiten, wenn man berücksichtigt, dass
- eine Wechselwirkung zwischen realen Gasteilchen den Druck eines Gases verringert ($p_\mathrm{real}<p_\mathrm{ideal}$) und
- reale Gasteilchen ein Volumen einnehmen und das Volumen eines realen Gases größer ist ($V_\mathrm{real}>V_\mathrm{ideal}$).
Die Van-der-Waals-Gleichung benötigt daher zwei zusätzliche Parameter: $a$ der Kohäsionsdruck und $b$ das Kovolumen. $$ p=\frac{RT}{V_m-b}-\frac{a}{V_m^2} ,$$
wobei $p$ der Druck des realen Gases, $R$ die universelle Gaskonstante, $T$ die Temperatur und $V_m$ das molare Volumen ist.
Diese wird häufig auch in der Form
$$\left(p+a\frac{n^2}{V^2}\right) \cdot(V-nb)=n\cdot R\cdot T$$
geschrieben.
Die Van-der-Waals-Gleichungen versagen im Falle eines Phasenwechsels, z.B. von flüssig nach gasförmig, da die Gleichung Isothermen beschreibt. An dieser Stelle ist eine Maxwell-Konstruktion von Nöten um die experimentellen Daten korrekt zu erklären.
Van-der-Waals-Konstanten
Diese Abweichungen von idealen Gasen sind unterschiedlich für alle Gase und wurden empirisch bestimmt. Für Luft beträgt $a=135,8\,\frac{kPa\,dm^6}{mol^2}$ und $b=0,0364\,\frac{dm^3}{mol}$. Die Parameter $a$ und $b$ lassen sich experimentell bestimmen, indem man im kritischen Punkt den kritischen Druck $p_c$ und die kritische Temperatur $T_c$ bestimmt $$ a=\frac{27(RT_c)^2}{64p_c} \qquad b=\frac{RT_c}{8p_C} .$$