meta data for this page
Carnot-Prozess
Allgemeines
Der Carnot-Prozess ist der thermodynamische Kreisprozess der das Optimum an Energieausbeute angibt, welches von einer Wärmekraftmaschine zwischen zwei Wärmereservoirs ($T_\mathrm{high}$ und $T_\mathrm{low}$) höchstens erreicht werden kann. Der Wirkungsgrad einer Carnot-Maschine ist $$\eta_\mathrm{Carnot}=-\frac{\Delta W}{\Delta Q}=\frac{T_\mathrm{high}-T_\mathrm{low}}{T_\mathrm{high}}=1-\frac{T_\mathrm{low}}{T_\mathrm{high}}\, ,$$ alle thermodynamischen Kreisprozesse haben einen Wirkungsgrad von $\eta \leq \eta_\mathrm{Carnot} < 1$.
Alle Wirkungsgrade sind immer $<1$, da höhere Wirkungsgrade gegen den zweiten Hauptsatz verstoßen würden. Alle realen Wärmekraftmaschinen, die zwischen zwei Wärmereservoirs mit Temperatur $T_\mathrm{high}$ und $T_\mathrm{low}$ arbeiten, haben einen Wirkungsgrad $\eta<\eta_\mathrm{Carnot}$, da durch die Verlustprozesse innerhalb realer Wärmekraftmaschienen das Optimum eines Carnot-Prozesses nicht erreicht werden kann. Als Arbeitsgas dient ein ideales Gas, ein weiterer Grund, weshalb Wirkungsgrade realer Prozesse immer $<1$ sind, da mit realen Gasen nicht verlustfrei zu arbeiten ist.
Arbeitsabschnitte des Carnot-Prozesses
Ablauf eines Carnot-Prozesses im T-S-Raum. Es gilt, dass die eingeschlossene Fläche ein Maß für die vom Prozess verrichtete Arbeit ist. Gut zuerkennen ist, dass die Temperatur gleich bleibt, trotz das Wärme zugeführt bzw. abgeführt wird.
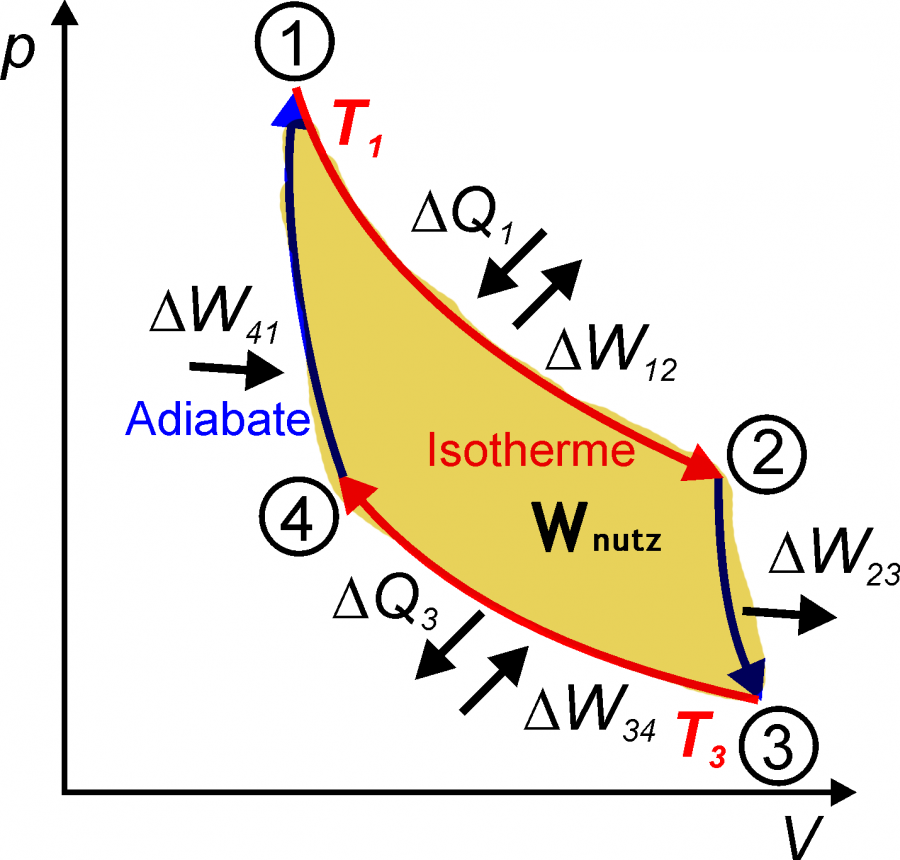 Auch im p-V-Diagramm gilt, dass die verrichtete Arbeit der im p-V-Diagramm eingeschlossenen Fläche entspricht. Bei einer isothermen Zufuhr von Wärme wird Arbeit verrichtet und das Volumen nimmt zu. Die Gas-Grundgleichung verlangt unter diesen Bedingungen eine Druckabnahme.
Auch im p-V-Diagramm gilt, dass die verrichtete Arbeit der im p-V-Diagramm eingeschlossenen Fläche entspricht. Bei einer isothermen Zufuhr von Wärme wird Arbeit verrichtet und das Volumen nimmt zu. Die Gas-Grundgleichung verlangt unter diesen Bedingungen eine Druckabnahme.
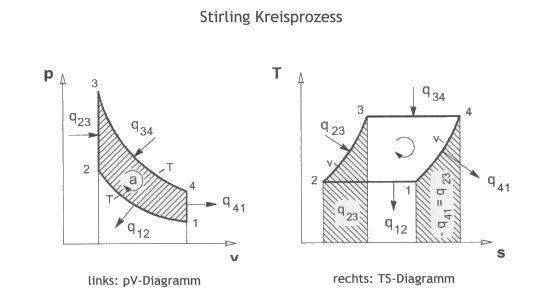 Der Stirling-Kreisprozess unterscheidet sich im Parameterraum deutlich vom Carnot-Kreisprozess. Trotzdem erreicht der Stirling-Prozess in der Theorie beinah die Werte vom Carnot-Prozess.
Der Stirling-Kreisprozess unterscheidet sich im Parameterraum deutlich vom Carnot-Kreisprozess. Trotzdem erreicht der Stirling-Prozess in der Theorie beinah die Werte vom Carnot-Prozess.
Der Carnot-Prozess besteht aus vier Abschnitten. In zwei Abschnitten wird Wärme zugeführt, bzw. abgeführt. In den anderen beiden findet kein Wärmeaustausch mit der Umgebung (Wärmereservoirs) statt. Diese Abschnitte sind isentrop, d.h. die Entropie ändert sich nicht. Trotzdem findet in diesen Abschnitten eine Expansion bzw. eine Kompression statt. Eine technische Realisierung des idealen Carnot-Prozesses ist nicht möglich ($\eta<\eta_\mathrm{Carnot}$).
1 $\rightarrow$ 2 - Isotherme Expansion
Durch Kontakt mit einem warmen Wärmereservoir nimmt das Arbeitsmedium die Wärme $Q_\mathrm{in}$ auf. Da das Arbeitsmedium in diesem Abschnitt isotherm sein soll, wird die zugeführte Wärme in Arbeit umgesetzt und das Arbeitsmedium dehnt sich nach $\delta Q = p \mathrm{d} V$ aus. Desweiteren nimmt der Druck ab.
2 $\rightarrow$ 3 - Isentrope Expansion (adiabatisch)
Im zweiten Schritt wird keine Wärme mehr zugeführt, das System ist isoliert. Trotzdem sinkt der Druck weiter und das Volumen vergrößert sich bis zu einem Maximalwert, dabei wird ebenfalls Arbeit verrichtet.
3 $\rightarrow$ 4 - Isotherme Kompression
Im dritten Schritt wird dem System durch Kontakt mit einem kälteren Wärmereservoir Wärme $Q_\mathrm{out}$ entzogen. Das Volumen verringert sich und der Druck steigt.
4 $\rightarrow$ 1 - Isentrope Kompression (adiabatisch)
Im vierten Schritt wird wieder keine Wärme zugeführt und das System isoliert. Dafür wird das Arbeitsmedium durch eine externe Kraft komprimiert. Der Druck steigt weiter an bis der Anfangszustand wieder erreicht ist.
Verrichtete Arbeit
Der erste Hauptsatz der Thermodynamik lautet $\mathrm{d}U=\delta W+\delta Q_\mathrm{ges}$ und für alle Kreisprozess gilt $\Delta U=0$. Es folgt für die vom Carnot-Prozess verrichtete Arbeit $$W=-Q_\mathrm{ges}=Q_\mathrm{1\rightarrow 2}+Q_\mathrm{3\rightarrow 4}=\left( T_\mathrm{1}-T_\mathrm{2}\right)\cdot\left( \Delta S\right)\, ,$$ wobei $Q=T\Delta S$ genutzt wurde.
Vergleich mit dem Stirling-Prozess
Der Stirling-Kreisprozess ist ein Prozess bestehend aus zwei isothermen und zwei isochoren Arbeitsschritten. Er wird genutzt um aus zwei Wärmereservoirs unterschiedlicher Temperatur mechanische Arbeit zu gewinnen.
3 $\rightarrow$ 4 - Isotherme Expansion
Die Temperatur ist konstant und es wird die Wärmemenge $Q_{3\rightarrow 4}$ aufgenommen. Die Wärme wird überführt in eine Volumensvergrößerung des Arbeitsmediums und die Arbeit $W_{3\rightarrow 4}$ wird abgegeben. Der Druck sinkt.
4 $\rightarrow$ 1 - Isochore Abkühlung
Das Volumen ist konstant und es wird die Wärmemenge $Q_{4\rightarrow 1}$ abgegeben. Druck und Temperatur sinken auf das Minimum im Kreisprozess.
1 $\rightarrow$ 2 - Isotherme Kompression
Die Temperatur ist erneut konstant und es wird die Wärmemenge $Q_{1\rightarrow 2}$ abgegeben. Zusätzlich wird Arbeit $W_{1\rightarrow 2}$ aufgenommen, d.h. der Luftdruck schiebt den Arbeitskolben zurück in den Zylinder und das Volumen verkleirnet sich. Der Druck steigt an.
2 $\rightarrow$ 3 - Isochore Erwärmung
Das Volumen ist konstant und es wird die Wärmemenge $Q_{2\rightarrow 3}$ aufgenommen. Druck und Temperatur steigen an und erreichen ihr Maximum im Kreisprozess.