meta data for this page
Entropie
Allgemeines
Entropie $S$ ist, neben Temperatur, Volumen und Druck, eine weitere Zustandsgröße eines thermodynamischen Systemes. Die Menge an Entropie ist nicht messbar und darf daher als virtuelle Hilfsgröße betrachtet werden. Trotzdem ist sie unerlässlich zum Beschreiben von thermodynamischen Prozessen und um zu gewährleisten, dass der zweite Hauptsatz eingehalten wird. Anschaulich ist Entropie ein Maß für die Anzahl an Mikrozustände/Möglichkeiten die ein System hat, einen gewissen Makrozustand einzunehmen.
Zum Beispiel sind “Biermoleküle” im Bierschaum auf die Wände der Bierschaumblasen eingeschränkt (geringe Entropie), hingegen in der Flüssigkeit selber können sie sich freier Bewegen (hohe Entropie). Thermodynamische Systeme tendieren dazu Zustände einzunehmen, in denen diese eine hohe Entropie besitzen. Ein anderes Beispiel ist ein neues Kartenspiel, am Anfang ist ein Kartenspiel geordnet und nach Farben sortiert. Wird das Kartenspiel gemischt, so wird es sich danach immer in einem ungeordneten Zustand befinden. Das liegt daran, dass der geordnete Zustand nur einer von sehr vielen Zuständen ist und die Wahrscheinlichkeit einen geordneten Zustand zu “ermischen” ungefähr $P(\mathrm{geordnet})=\frac{1}{32!}\approx\frac{1}{2,6\cdot 10^{35}}\approx 0$ ist.
Definition
Entropie wird in der Thermodynamik definiert über die Änderung der Entropie $\Delta S$, also indirekt, da nicht die Größe des Wertes der Entropie eines Systemes relevant ist, sondern nur die Änderung der Entropie. $$\Delta S = \frac{Q}{T}\quad \left[\frac{\mathrm{J}}{\mathrm{K}}\right]$$ Mit $Q$ der zu-/ abgeführten Wärme und $T$ der zu dem Zeitpunkt vorhandenen System-Temperatur.
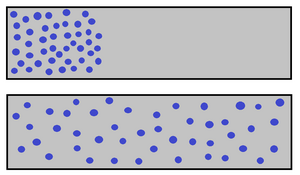
Stochastische Deutung der Entropie
Wenn ein System sich durch einen Prozess von Zustand A zu Zustand B verändert und die Wahrscheinlichkeit dafür, dass System in dem Zustand B vorzufinden größer ist, dann nimmt die Entropie zu.
Ein Beispiel wären zwei Boxen, die durch eine kleine Öffnung verbunden sind. In einer Box befindet sich anfangs ein Gas, in der anderen Vakuum (Zustand A). Die Gasmoleküle werden durch das Loch ausströmen (Prozess) und sich gleich über beide Boxen verteilen (Zustand B).
Weiterführendes? Hier klicken!
Umgang mit Entropie
Nimmt ein thermodynamisches System zur Energieumwandlung die Wärme $Q_1>0$ auf, so nimmt es auch Entropie auf, es gilt $$\Delta S_1 = \frac{Q_1}{T_1}>0\, ,$$ wobei $T_1$ die Temperatur ist, bei der das System die Wärme aufnimmt. Nun wird das System sich Aufgrund der zugeführten Wärme verändern und z.B. das Volumen vergrößern und den Druck verringern und dabei Arbeit verrichten. Damit das System wieder in den Ursprungszustand zurückgeführt wird, muss es nun wieder Wärme abgegeben $Q_2<0$ und das Volumen verkleinern, dabei verringert sich die Entropie im System um $$\Delta S_2 = \frac{Q_2}{T_2}<0\, ,$$ wobei hier die Temperatur $T_2$ eine andere ist, als die, bei der das System die Wärme aufgenommen hat.
Gilt $\frac{Q_1}{T_1}+\frac{Q_2}{T_2}=\Delta S_1 + \Delta S_2=0$, so ist der Prozess reversibel, d.h. er kann in beide Richtungen ausgeführt werden. Der Wirkungsgrad ist $\eta = 1$ und die Gesamtentropie bleibt konstant.
Gilt $\frac{Q_1}{T_1}+\frac{Q_2}{T_2}=\Delta S_1 + \Delta S_2<0$, so ist der Prozess irreversibel, d.h. er kann nicht in beide Richtungen ausgeführt werden. Dies sind alle natürlichen Prozesse und für uns reversibel erscheinende Prozesse zeigen nicht direkt ihre Verluste, z.B. durch Luftreibung. Der Wirkungsgrad ist $\eta < 1$, es geht Energie bei der Umwandlung verloren. Desweiteren wird Entropie erzeugt, die Gesamtentropie nimmt also zu. Es gibt keinen Prozess der Entropie vernichtet. Mit der Erzeugung von Entropie ist keine physikalische Arbeit verbunden.
Äquivalente Formulierung des zweiten Hauptsatzes
In abgeschlossenen Systemen laufen solange Entropie-erzeugende Prozesse ab, wie diese vorhanden sind. Danach ist die maximale Menge an Entropie für dieses System erreicht. $$\Delta S \geq 0$$