meta data for this page
This is an old revision of the document!
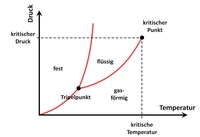
p-T-Diagramm
Das p-T-Diagramm heißt auch “Phasendiagramm”.
Allgemeines
Das Druck-Temperatur-Diagramm, oder auch Phasendiagramm, gibt den Zustand eines Gases an und kann benutzt werden um den Aggregatzustand (auch Phase genannt) zu bestimmen.
Typischer Weise ist ein p-T-Diagramm in drei Bereiche eingeteilt: fest, flüssig, gasförmig. Desweiteren lassen sich Tripelpunkt und kritischer Punkt ablesen.
Oberhalb der kritischen Temperatur werden Gase nicht mehr flüssig, auch wenn man den Druck noch so erhöht.
Tripelpunkt
Im Tripelpunkt treten alle drei klassischen Phasen gleichzeitig und im Gleichgewicht auf. Der Tripelpunkt von Wasser legt die Temperaturskala in Grad Kelvin fest.
Kritischer Punkt
Im kritischen Punkt besitzen die flüssige Phase und die Gasphase die gleiche Dichte und sind nicht mehr zu unterscheiden. Im Phasendiagramm stellt der kritische Punkt das obere Ende der Dampfdruckkurve dar. Über diesen Punkt hinaus spricht man von überkritischen Fluiden, die z.B. genutzt werden um Kaffee zu entkoffeinieren.